أدخل كلمة أو عبارة بأي لغة 👆
اللغة:
ترجمة وتحليل الكلمات عن طريق الذكاء الاصطناعي ChatGPT
في هذه الصفحة يمكنك الحصول على تحليل مفصل لكلمة أو عبارة باستخدام أفضل تقنيات الذكاء الاصطناعي المتوفرة اليوم:
- كيف يتم استخدام الكلمة في اللغة
- تردد الكلمة
- ما إذا كانت الكلمة تستخدم في كثير من الأحيان في اللغة المنطوقة أو المكتوبة
- خيارات الترجمة إلى الروسية أو الإسبانية، على التوالي
- أمثلة على استخدام الكلمة (عدة عبارات مع الترجمة)
- أصل الكلمة
%ما هو (من)٪ 1 - تعريف
Пептидная связь
вид амидной связи; возникает при образовании белков (См. Белки) и пептидов (См. Пептиды) в результате взаимодействия α-аминогруппы (-NH2) одной аминокислоты с α-карбоксильной группой (-СООН) др. аминокислоты: 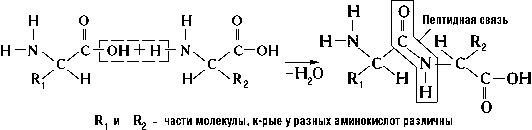
Группа -СО-NH- в белках находится в состоянии кето-енольной таутомерии (См. Таутомерия). 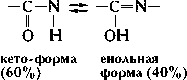
Наличие П. с. в белках и пептидах было предположено А. Я. Данилевским (См. Данилевский) и Э. Фишером и затем подтверждено химическими и физическими данными. Благодаря таутомерии П. с. имеет частично (на 40\%) характер двойной (сопряжённой) связи, что проявляется в уменьшении её длины (1,32Å), по сравнению с длиной одинарной -С-N- связи (1,47Å) (см. Химическая связь). Частично сопряжённый характер - С-N- связи обусловливает плоскую конфигурацию -СО-NH- группы (все 4 атома компланарны, то есть находятся в одной плоскости) и существование транс- и цис-форм:
Экспериментально доказана большая устойчивость транс-формы (см. Изомерия). Ферментативное образование П. с. в живых клетках происходит в процессе биосинтеза белка. Разработаны методы химического и ферментативного лабораторного синтеза и расщепления П. с., позволившие синтезировать ряд биологически активных пептидов, а также установить аминокислотную последовательность для многих белков и пептидов.
Н. Н. Зайцева.
ПЕПТИДНАЯ СВЯЗЬ
(-CO-NH-) , химическая связь, соединяющая аминогруппу одной аминокислоты с карбоксильной группой другой в молекулах пептидов и белков.
Пептидная связь
Пептидная связь — вид амидной связи, возникающей при образовании белков и пептидов в результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты.
ويكيبيديا
Пептидная связь
Пептидная связь — вид амидной связи, возникающей при образовании белков и пептидов в результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты.
Из двух аминокислот (1) и (2) образуется дипептид (цепочка из двух аминокислот) и молекула воды. По этой же схеме рибосома генерирует и более длинные цепочки из аминокислот: полипептиды и белки. Разные аминокислоты, которые являются «строительными блоками» для белка, отличаются радикалом R.

